G1 Farmakodynamikk
Publisert: 27.05.2013
Sist endret: 05.2015
Olav Spigset
Innledning
Farmakodynamikk beskriver og forklarer effekter av legemidler. Dette omfatter biokjemiske effekter i celler og fysiologiske effekter i vev og organer, men også effekter hos enkeltindivider og grupper av individer. Oftest forbinder man farmakodynamikk med ønskede effekter av legemidler, men farmakodynamikken gir også bakgrunn for å forstå bivirkninger og visse typer interaksjoner. Se også G5 Bivirkninger og legemiddelovervåking og G6 Interaksjoner.
Mottakermolekyler for legemidler
Et legemiddel utøver en effekt på flere ulike nivåer. For det første vil legemidlet binde seg til og påvirke et mottakermolekyl. Dette utløser en respons i de cellene der mottakermolekylet finnes. Som en følge av dette vil det skje en forandring i det vevet der de aktuelle cellene finnes og i det organet der det aktuelle vevet finnes.
Det finnes ulike typer mottakermolekyler. De fire hovedtypene er reseptorer, ionekanaler, transportproteiner og enzymer, som alle er proteiner. I tillegg finnes det mottakermolekyler som ikke er proteiner, som f.eks. nukleinsyrene DNA og RNA. Noen eksempler på mottakermolekyler for legemidler presenteres i Tabell 1 G1 Tabeller.
Typer av legemiddeleffekter
Generelt virker legemidler ved å stimulere eller hemme fysiologiske prosesser. For at et legemiddel skal utøve en effekt, er det to forutsetninger som må oppfylles. For det første må legemidlet finnes i en passende konsentrasjon på virkestedet, noe som igjen forutsetter at det er gitt i en passende dose. De prinsippene som bestemmer hva som er en passende dose av et legemiddel, omtales i kapittel G2 Farmakokinetikk. For det andre må legemidlet kunne bindes til mottakermolekylet.
Legemidler kan utøve to prinsipielt forskjellige effekter på de mottakermolekylene de bindes til. En agonist virker på samme måte som en endogen substans ved at den stimulerer mottakermolekylet og starter eller forsterker en cellefysiologisk prosess. En antagonist blokkerer mottakermolekylet og hemmer den cellefysiologiske prosessen. Noen antagonister er partielle agonister. Det betyr at de virker hemmende i nærvær av den naturlig forekommende agonisten, men svakt stimulerende i fravær av den.
Når to eller flere legemidler via ulike mekanismer gir en forsterket virkning, kalles dette synergisme. Risikoen for bivirkninger vil da kunne bli lavere, siden dosen av legemidlene kan reduseres. Eksempler på dette er å behandle astma med en kombinasjon av glukokortikoider og betareseptorstimulatorer eller å behandle hypertensjon med en kombinasjon av tiaziddiuretika og ACE-hemmere. Dette er tilsiktede interaksjoner, men det forekommer også utilsiktede interaksjoner som gir opphav til bivirkninger eller mangelfull effekt. Se også G6 Interaksjoner.
Effektspesifisitet
Legemidler påvirker cellefysiologiske prosesser mer eller mindre spesifikt. Det er ofte ønskelig at et legemiddel bare påvirker én reseptor og ett organsystem, men fordi biologiske prosesser ofte er de samme i ulike vev, får man vanligvis forutsigbare, men uønskede effekter fra andre organsystemer. Når det likevel er mulig å utvikle relativt organspesifikke legemidler, skyldes det at de biologiske prosessene ofte uttrykkes ulikt i forskjellige vev. Ved å bruke beta-2-reseptoragonister i behandlingen av astma begrenses stimuleringen av hjertet via beta-1-reseptorer. Faren for bivirkninger reduseres ytterligere ved å velge en selektiv administrasjonsvei som inhalasjon. Antipsykotiske legemidler blokkerer i større eller mindre grad ulike reseptorer som dopamin D2-reseptorer, serotonin 5-HT2A-reseptorer, histamin H1-reseptorer osv. Bruk av antipsykotiske legemidler med kraftige antihistamineffekter kan være en fordel hos urolige og søvnløse pasienter, men den sedasjonen som slike midler gir, kan i andre situasjoner fremstå som plagsomme bivirkninger. Enzymet fosfodiesterase (cGMP-spesifikk fosfodiesterase type 5) finnes i store mengder i corpus cavernosum. Hemmere av dette enzymet, som sildenafil, brukes mot erektil dysfunksjon. Enzymet er imidlertid også uttrykt i retina, noe som forklarer at endret fargesyn er en vanlig bivirkning.
I høye konsentrasjoner kan et legemiddel også bindes til andre reseptorer enn den eller de som er viktigst ved lave konsentrasjoner. Dette er en viktig forklaring på at legemidler gir bivirkninger når dosen økes. F.eks. kan selektive beta-1-reseptorantagoniser (betablokkere) miste noe av sin selektivitet og utløse astmaanfall ved bruk av høyere doser via blokade av beta-2-reseptorer.
Dose–effektrelasjoner
For de fleste legemidler ser man en gradvis økning av effekten når dosen økes, inntil man oppnår en maksimal effekt. Når doseringen er så høy at legemidlets maksimale effekt er nådd, har det ingen hensikt å øke dosen ytterligere (se figur G1.1), siden dette bare øker risikoen for bivirkninger. I slike situasjoner må man i stedet vurdere å skifte til et legemiddel som virker via et annet mottakermolekyl og gir en høyere maksimal effekt. Et eksempel på dette er å bytte fra tiazider til slyngediuretika om man ønsker en kraftigere diuretisk effekt. Et annet alternativ er å supplere med et annet legemiddel som gir en synergistisk effekt (se G1 Typer av legemiddeleffekter).
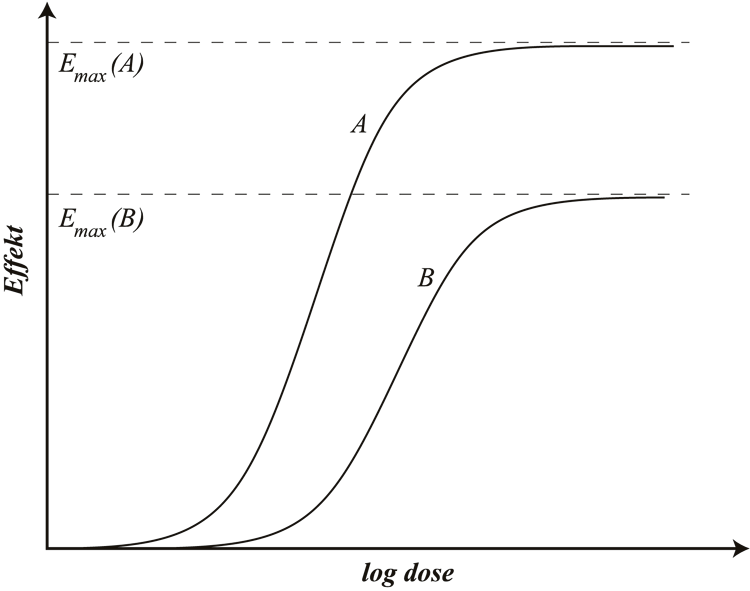
Figur G1.1 Dose-effekt-kurver for legemidlene A og B. Figuren viser graderte effekter, dvs. at det er en kontinuerlig økning i effekten som følge av en doseøkning inntil Emax nås. Utover dette har det ingen hensikt å øke maksimaldosen. For å få større effekt kan man bytte fra legemiddel B til legemiddel A. Observer at x-aksen er logaritmisk
Dose–frekvensrelasjoner
Dose–frekvensrelasjoner studeres alltid i grupper av individer og sier noe om hvor mange individer som oppnår en bestemt effekt ved en gitt dose (se figur G1.2). Selv om denne relasjonen har samme form som dose–effektkurven, har disse farmakodynamiske uttrykkene forskjellig mening. Relasjonen mellom dose og frekvens viser at enkeltindivider kan ha ulik følsomhet for legemidler. Dersom man gir en og samme dose til alle, og denne dosen er tilpasset slik at alle får ønsket terapieffekt, vil en rekke individer bli overdosert med økt risiko for bivirkninger (dosen merket A i figur G1.2). I kliniske utprøvinger studeres dose–frekvensrelasjoner på gruppenivå. På bakgrunn av disse studiene er det mulig å anbefale en dosering som gir en ønsket effekt med et minimum av bivirkninger hos pasienter flest (dosen merket B i figur G1.2.). I praksis må man alltid vurdere en dosereduksjon når bivirkninger inntrer eller en doseøkning ved manglende effekt, selv om pasienten får den anbefalte doseringen.
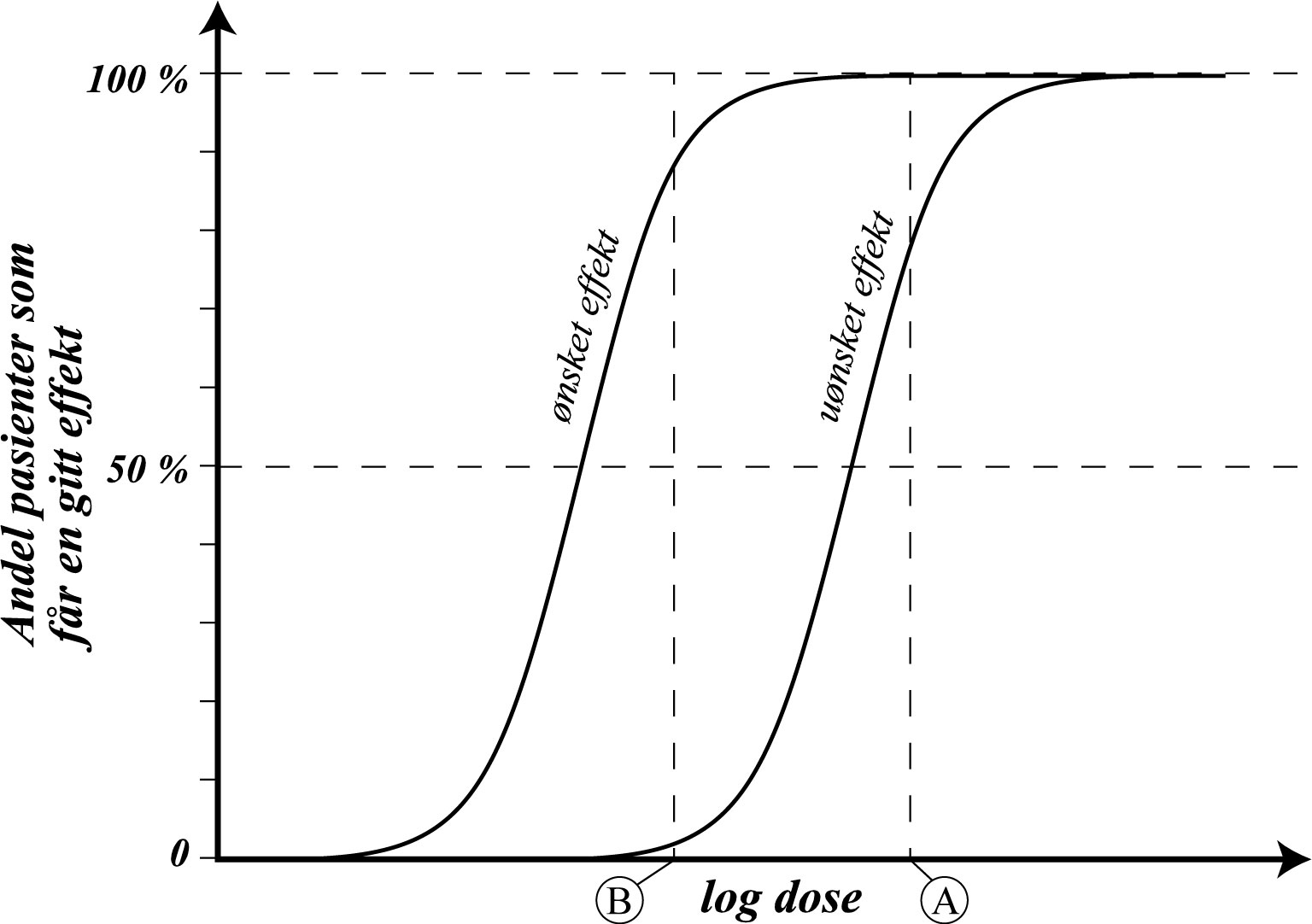
Figur G1.2 Dose-frekvens-kurver for en gruppe pasienter. Figuren viser den andelen av pasientene som oppnår en definert ønsket effekt og en gitt uønsket effekt ved økende dosering av et legemiddel. Denne type kurver sier ikke noe om størrelsen av effekten, men forteller hvor mange som oppnår en bestemt effekt. A viser en dose der alle får ønsket effekt, men mange dessuten får en uønsket effekt (bivirkning). B viser en dose der balansen mellom hvor mange som får ønsket og hvor mange som får uønsket effekt er optimal. Observer at x-aksen er logaritmisk.
Dosering for å oppnå optimal effekt
Når man skal velge dosering for å oppnå en optimal effekt hos en enkelt pasient, må man ta hensyn til fysiologiske forhold (f.eks. alder og vekt) og patofysiologiske forhold (f.eks. hjertesvikt og nyresvikt) som påvirker farmakokinetikken. (Se G2 Farmakokinetikk G2 Farmakokinetikk og doseringsprinsipper.) Videre bør man velge den administrasjonsformen som gir høyest grad av ønsket organselektivitet. Når man antar at optimal konsentrasjon er oppnådd på virkestedet, vurderes effekten på grunnlag av kliniske observasjoner og ev. laboratoriemålinger. Dersom responsen ikke svarer til det forventede, må man vurdere doseringen på nytt og justere dosen eller velge et annet legemiddel. Det å individualisere doseringen av legemidler som brukes profylaktisk kan være spesielt vanskelig, fremfor alt når legemidlet har et smalt terapeutisk vindu. Dette gjelder f.eks. legemidler som brukes for å forebygge epileptiske anfall og hjertearytmier. I slike situasjoner styres doseringen ofte med støtte av serumkonsentrasjonsmålinger. Det kan også være indikasjon for serumkonsentrasjonsmålinger når uventede effekter oppstår, selv om det er tatt hensyn til fysiologiske og patofysiologiske forhold. Se også G16 Analyser av farmakologiske substanser og farmakogenetikk
Tid til effekt, og varighet av effekt etter seponering
I cellulære systemer vil effekter av noen legemidler, f.eks. midler som påvirker ionekanaler, kunne påvises i løpet av millisekunder. Effekter som er avhengige av syntese og/eller nedbrytning av proteiner, inntrer derimot først i løpet av timer eller dager. Forskjellige legemidler som brukes mot samme tilstand, kan også ha forskjellig latenstid. Heparin virker svært raskt, mens warfarin har en latenstid på flere dager. Årsaken er at heparin har en nærmest umiddelbar effekt på plasmaproteiner som inngår i koagulasjonsprosessene, mens warfarin hemmer syntesen av enkelte koagulasjonsfaktorer. Full effekt av warfarin oppnås derfor først når det har oppstått en ny balanse mellom syntese og eliminasjon av disse faktorene. Andre typer legemiddeleffekter kommer i løpet av uker, slik som antipsykotiske og antidepressive effekter. Mekanismene for den sene effektutviklingen er ikke fullt ut klarlagt, men skyldes trolig at det tar tid før endogene signalsystemer innstilles på et nytt funksjonsnivå.
For legemidler som bindes reversiblet til målstrukturen, er det legemidlets halveringstid som bestemmer hvor lang tid det tar før det er ute av kroppen, og dermed også hvor lenge effekten vedvarer etter seponering (se G2 Farmakokinetikk og doseringsprinsipper).
Noen legemidler hemmer målstrukturene irreversibelt. Dermed vil effekten vedvare også etter at legemidlet er ute av kroppen. Et slikt legemiddel er acetylsalisylsyre, som irreversibelt inaktiverer enzymet syklooksygenase i trombocytter. Dermed blokkeres syntesen av tromboksan A2, og trombocyttfunksjonen hemmes. Siden blokaden er irreversibel, må det produseres en ny trombocyttpopulasjon før funksjonen helt normaliseres, noe som i regelen tar inntil en uke.
Endring av vevsfølsomhet
Mange reaksjoner i celler og organer reguleres av endogene substanser (hormoner, nevrotransmittere etc.) som virker ved å binde seg til og aktivere spesifikke reseptorer. Disse systemenes følsomhet for endogene substanser så vel som for legemidler kan variere ut fra både fysiologiske forhold (f.eks. genetisk variasjon og alder) og patofysiologiske fenomener (f.eks. endret følsomhet for katekolaminer ved hjertesvikt og hypertyreose). Dette er en årsak til at det er en betydelig interindividuell og intraindividuell variasjon i legemiddeleffekter.
Toleranseutvikling fører til at legemiddeldosen må økes for å få like stor effekt som ved behandlingsstart. Fenomenet er velkjent ved behandling med opioider og benzodiazepiner, men forekommer også for andre legemidler som f.eks. glyseroltrinitrat. På cellulært nivå kjennetegnes dette ved redusert antall reseptorer og/eller at reseptoren frakoples det cellulære effektorsystemet (nedregulering). Ved behandling med reseptorantagonister vil en kompensatorisk økning i antallet funksjonelle reseptorer på tilsvarende måte føre til en økt følsomhet (oppregulering). Brå seponering av agonister og antagonister kan gi abstinensfenomener og seponeringssymptomer/«rebound»-fenomener. Dette skyldes at påvirkningen av legemidlet forsvinner før systemet har rukket å gjenopprette en normal funksjonstilstand. Man kan f.eks. se en adrenerg overreaksjon ved plutselig seponering av betablokkere. Dette kan gi seg uttrykk som takykardi eller andre arytmier, og i verste fall hjerteinfarkt hos pasienter med koronarsykdom. Andre eksempler er intranasal vasodilatasjon etter langtidsbehandling med slimhinneavsvellende nesespray og seponeringssymptomer ved plutselig behandlingsstopp med selektive serotoninreopptakshemmere. Seponeringsfenomener forekommer også når et legemiddel har undertrykt produksjonen av endogen agonist. F.eks. kan plutselig seponering av glukokortikoider gitt systemisk over lengre tid utløse en binyrebarksvikt.
I noen tilfeller kan man få toleranse for et legemiddels bivirkninger, slik at bivirkningsplagene reduseres med tiden selv om behandlingen fortsettes med samme dosering som tidligere. Eksempler på slike bivirkninger er sedasjon ved bruk av antihistaminer og kvalme ved bruk av selektive serotoninreopptakshemmere.
Praktiske konsekvenser
Ved tilstander som ikke krever en øyeblikkelig maksimal effekt, bør man starte med en lav dose og øke dosen gradvis over tid, fordi noen individer har en økt vevsfølsomhet både når det gjelder ønskede effekter og bivirkninger. Ved god klinisk oppfølging kan man i de fleste tilfeller finne en optimal individtilpasset dose.
Dersom en pasient med en individtilpasset dosering får en annen sykdom i tillegg, må man revurdere dosen med tanke på endringer i vevsfølsomhet.
Ved seponering av legemidler som virker via spesifikke målproteiner bør man, i den grad det er praktisk mulig, foreta en gradvis nedtrapping.