Om Legemiddelhåndboken
Revidert: 02.06.2023
Sist endret: 16.10.2024
Forord
Norsk legemiddelhåndbok for helsepersonell er en terapirettet oppslagsbok om legemidler som behandlingsalternativ. Den er spesielt beregnet på den allmennpraktiserende lege og institusjonslegen på områder hvor vedkommende ikke er spesialist. Det er derfor lagt særlig vekt på å omtale tilstander som primært behandles av disse legene, og hvor legemidlene har en viktig plass i behandlingen. Men også hyppig forekommende tilstander som ikke kan behandles medikamentelt, omtales kortfattet. Sjeldnere tilstander er bare gitt en orienterende omtale.
Norsk legemiddelhåndbok for helsepersonell er delt i 4 hovedavsnitt: en sykdomsrettet del (24 kapitler) med terapiopplegg, en del med legemiddelomtaler (23 kapitler), en generell del (27 kapitler) som omfatter ulike behandlingssituasjoner, klinisk, farmakologisk og formell veiledning ved legemiddelbruk, og en registerdel med bl.a. stikkord- og adresseregister.
For opplysninger om vilkår for refusjon på blå resept for de enkelte legemidlene, henvises det til Direktoratet for medisinske produkter. Direktoratet for medisinske produkter utarbeider og ajourholder refusjonslisten (med refusjonskoder). Se også under Refusjonsordninger for legemidler for mer informasjon.
Ansvaret for opplegg av boken, dens endelige innhold og utforming ligger hos et faglig selvstendig redaksjonsutvalg. De enkelte kapitler og delavsnitt er utarbeidet av en eller flere primærforfattere. De er deretter vurdert av spesialister innen sine fagområder og i tillegg av redaksjonsutvalget. Vel 200 medarbeidere deltar i revisjonsarbeidet. Disse er ført opp i et eget medarbeiderregister tilgjengelig på nett.
På engelsk heter vi: The Norwegian Medicines Manual for Health Personnel
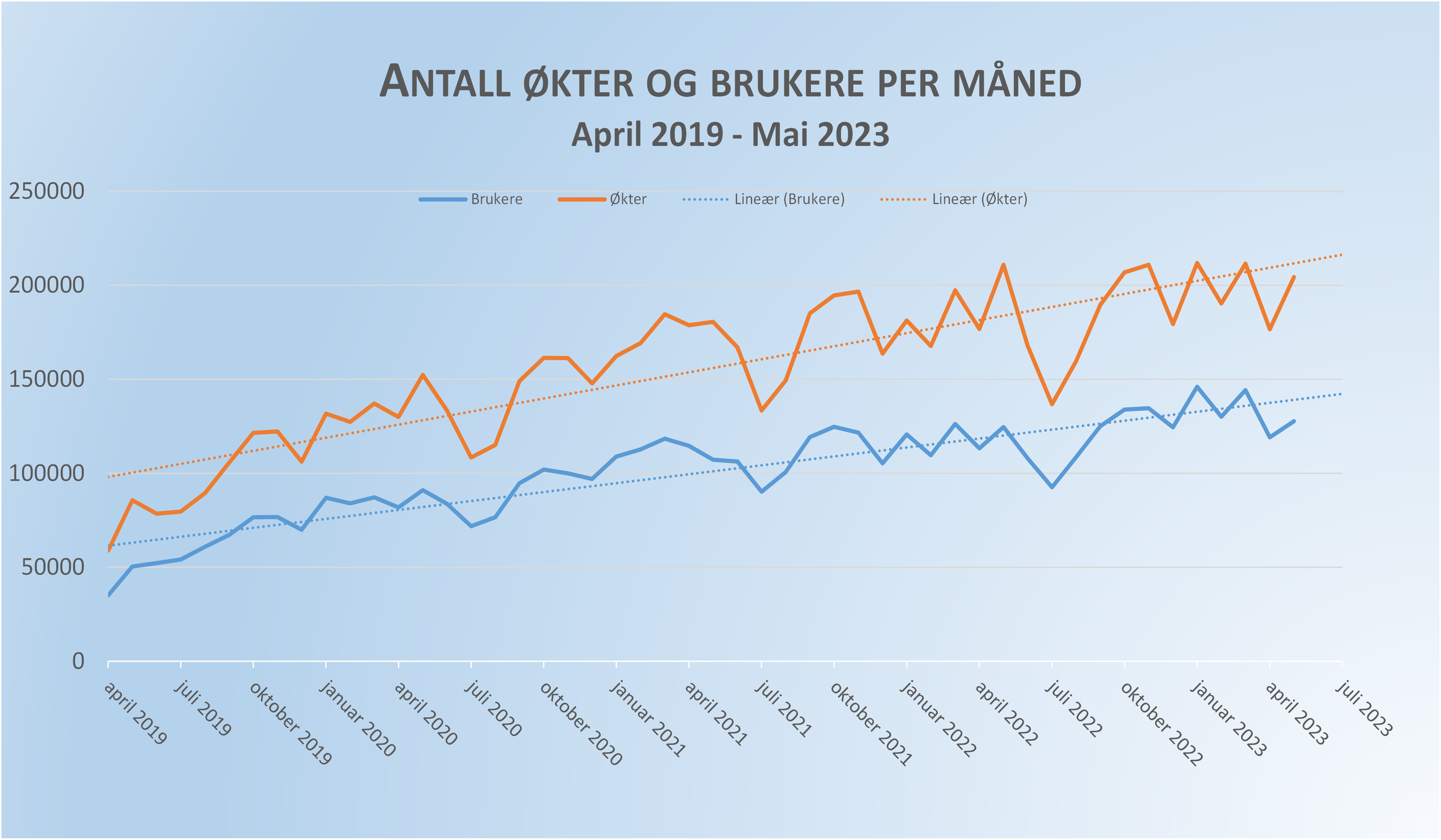
Antall økter og brukere
Terapikapitlene
Terapikapitlene (T-kapitlene) samsvarer i hovedsak med WHOs sykdomsklassifikasjon (diagnosegrupper). Eksempler på terapikapitler er «Hjerte-karsykdommer», «Mage-tarmsykdommer», «Hudsykdommer». I hvert terapikapittel omtales de viktigste sykdommene med en kort beskrivelse av sykdommen som grunnlag for indikasjonsstilling og valg mellom ulike behandlingsalternativer, primært medikamentell behandling, men også ikke-medikamentell. Der det er mulig, gis det råd om valg av behandling, fortrinnsvis på objektivt faglig grunnlag, men rådene preges delvis av empiri og norske terapitradisjoner.
Legemiddelkapitlene
Med unntak av T21 Palliativ behandling og T24 Radiologi og nukleærmedisin er legemiddelkapitlene (L-kapitlene) inneholdende omtaler av de legemidler som har sine hovedindikasjoner inn under terapikapitlene med tilsvarende nummer. Legemiddelkapitlene består av legemiddelomtaler og preparatlister:
-
I legemiddelomtalene beskrives legemidlenes egenskaper og forhold legen bør kjenne til ved forskrivning og oppfølging av behandlingen (farmakokinetikk, dosering og administrasjon, bivirkninger, interaksjoner, graviditet, amming, forsiktighetsregler, kontraindikasjoner, kontroll og oppfølging, seponering). De viktigste indikasjoner nevnes. Ikke-godkjente indikasjoner "off-label" ev. "off-licence" kan være nevnt dersom slik bruk er omtalt i terapikapitlene og/eller benyttes i klinisk praksis.
Vær oppmerksom på at opplysninger i boken kan avvike fra tilsvarende opplysninger fra legemiddelprodusentene eller i godkjente preparatomtaler. Produsentenes preparatomtaler kan ha mer omfattende lister over kontraindikasjoner enn det som fremgår fra Legemiddelhåndboken. Dette skyldes blant annet Legemiddelhåndbokens tilgrunnliggende dokumentasjon er basert på uavhengige kilder og at den ikke skal være en uttømmende kilde til legemiddelinformasjon, men gi sentral, praktisk anvendbar og håndterbar informasjon. Kontraindikasjoner som skyldes legemiddelinteraksjoner omtales ikke i boken siden oppdatert informasjon om dette er tilgjengelig i beslutningsstøttesystemer og nasjonale databaser. Det samme gjelder den generelle kontraindikasjonen overfølsomhet overfor det aktuelle virkestoffet eller noen av hjelpestoffene i preparatet. For komplette lister over produsentenes kontraindikasjoner henvises det til Direktoratet for medisinske produkters nettsider, www.legemiddelsok.no.
Når det gjelder legemiddelgrupper som f.eks. adrenerge betareseptorantagonister, ACE-hemmere, NSAID, omtales gruppens egenskaper først under ett, deretter omtales enkeltmidlene med sine særegne egenskaper (som ikke deles med resten av gruppen; bl.a. doseringen).
-
I preparatlisten er preparatet(ene) ført opp under legemidlets generiske navn, ev. i alfabetisk rekkefølge. Med få unntak er alle preparater som er markedsført i Norge til humanbruk, nevnt i Legemiddelhåndboken, dertil enkelte preparater som ikke har markedsføringstillatelse i Norge (se G20 Forskrivning av legemidler på godkjenningsfritak ), «Apotek»-preparater og noen magistrelt forskrevne preparater. Til de generiske navn er det koblet en kode som angir hvilken reseptgruppe legemidlet tilhører, videre markeres trafikkrisiko og ev. refusjon på blå resept.
Utgifter til enkelte legemidler refunderes etter spesiell søknad etter § 3 i Refusjonsreglene. Slike opplysninger står ikke i Norsk legemiddelhåndbok.
Under hvert generisk navn følger en liste over de tilhørende spesialpreparater med navn, fabrikant, legemiddelformer, styrker, pakninger og godkjent maksimal utsalgspris på reseptbelagte legemidler. Trinnpris er satt inn for preparater som omfattes av dette systemet. Det er ikke angitt priser på reseptfrie preparater.
Biotilsvarende legemidler. Et biotilsvarende legemiddel lages med utgangspunkt i et originalt biologisk legemiddel. Medisiner som lages ved hjelp av levende organismer (bakterier, sopp, cellekulturer) kalles ofte biologiske legemidler, og omfatter blant annet interferoner, monoklonale antistoffer og hormoner. Når patentet på et originalt biologisk legemiddel går ut, kan et firma lage et nytt legemiddel – et biotilsvarende legemiddel - basert på det originale biologiske legemidlet. Til forskjell fra vanlige generiske legemidler sammenlignes effekten av biotilsvarende legemidler med originallegemidlet i pasientstudier. Dette er nødvendig for å være sikker på at de har samme virkning og ikke flere bivirkninger. Alle biotilsvarende legemidler har felles europeisk godkjennelse.
De generelle kapitlene
De to første delene av Legemiddelhåndboken, terapikapitlene og legemiddelkapitlene, omhandler avgrensede sykdommer og legemiddelgrupper. I den tredje delen i de 27 generelle kapitlene (G-kapitlene), gjøres det bla. rede for farmakoterapeutiske emner som går på tvers av de spesifikke terapikapitlene, samt andre emner.
Den generelle delen av Legemiddelhåndboken kan leses som en liten lærebok av kolleger som ønsker å friske opp sine farmakologiske og farmakoterapeutiske kunnskaper. Hovedhensikten er imidlertid å gi leseren et oppslagsverk som kan gi svar på spørsmål knyttet til generelle farmakologiske prinsipper, farmakoterapi for ulike pasientgrupper og praktiske sider ved legemiddelforskrivning.
Noen av de generelle kapitlene, for eksempel Graviditet og legemidler (G7) og Amming og legemidler (G8) kan inneholde informasjon som i noen tilfeller avviker fra tilsvarende informasjon fra legemiddelprodusentene eller i godkjente praratomtaler. Dette kan også gjelde når disse kildene angir at bruken av legemidlet er kontraindisert. Forskjellene skyldes gjerne at det er brukt uavhengige kilder i Legemiddelhåndboken, i kombinasjon med tolkningen av de rådataene som ligger til grunn. I tillegg veies det i graviditetskapitlet i Legemiddelhåndboken inn hvilken risiko mors ubehandlede grunnsykdom kan utgjøre for barnet.
Redaksjonen oktober 2024
Sturla Pilskog. Redaktør, daglig leder. Lege, spesialist i generell kirurgi og urologi
Ketil Berstad. Seniorrådgiver. Dr. med., spesialist i generell kirurgi og torakskirurgi, Idrettslege NIMF, MHA
Helene Hartvedt Grytli. Seniorrådgiver, MPharm, PhD
Lise Román Moltzau. Seniorrådgiver. Cand.pharm. PhD
Line Buan. Seniorrådgiver. MPharm. (vikar)
Redaksjonsutvalget oktober 2024
Olav Spigset, Dr. med., spes. klinisk farmakologi, overlege St. Olavs Hospital og professor NTNU Trondheim (leder)
Marit Stordal Bakken, overlege ph.d. UiB og NORCE Norwegian Research Centre AS
Ingrid Aas, spes. allmennmedisin, overlege Direktoratet for medisinske produkter (tidl. Statens legemiddelverk)
Harald Jodalen, Dr. med., spes. allmennmedisin, førsteamanuensis UiO, overlege Nasjonal militærmedisinsk poliklinikk, fastlege Oslo
Else Johanne Rønning, spesialist indremedisin og infeksjonssykdommer, seksjonsoverlege, Vestre Viken HF, Bærum sykehus
Henrik Schirmer, overlege professor, Hjertemedisinsk avdeling, Ahus
Kirsten K. Viktil, Cand. pharm., Ph.D, spes. sykehusfarmasi Diakonhjemmet sykehusapotek, førsteamanuensis Farmasøytisk institutt, UiO
Siri Wang, Cand. pharm, Dr. scient., Direktoratet for medisinske produkter (tidl. Statens legemiddelverk)
Sigrid Narum, PhD, MHA, spes. klinisk farmakologi og ØNH-sykdommer, overlege Seksjon for Legemiddelkomité og -sikkerhet, Avd. for Farmakologi, Oslo universitetssykehus og Nasjonalt senter for legemiddelmangel og -beredskap for spesialisthelsetjenesten (Mangelsenteret)
Tormod Kyrre Guren, overlege Avdeling for kreftbehandling, Radiumhospitalet, Oslo Universitetssykehus
Styrets sammensetning juni 2023
Styreleder: Områdedirektør Dag Jordbru (Direktoratet for medisinske produkter),
(varamedlem: Enhetsleder Vibeke Åbyholm)Medlem: Enhetsleder Oddny Grete Råd (Direktoratet for medisinske produkter),
(varamedlem: Enhetsleder Elisabeth Bryn)Medlem: Seniorrådgiver Børge Myrlund Larsen (Helsedirektoratet),
(varamedlem: Avdelingsdirektør Morten Græsli)Medlem: Seniorrådgiver Åse S. Skjerdal (Folkehelseinstituttet),
(varamedlem: Seniorrådgiver Kjell Tjensvoll)Medlem: Fagdirektør Hanne Andresen (Apotekforeningen),
(varamedlem: seniorrådgiver Tore Reinholdt)Medlem: Spesialrådgiver Anita Lyngstadaas (Den Norske legeforening),
(varamedlem: Seksjonssjef Jan Emil Kristoffersen)